研究紹介・実績
研究紹介 (※業績リストは右「業績」をクリック)
細胞が生きていくためには内外の環境変化に適切に対応し、安定した状態を維持することが重要であり、これを恒常性(ホメオスタシス)と呼びます。真核生物は細胞内に多くのオルガネラ(細胞小器官)を持ち、個々のオルガネラはそれぞれ固有の生理機能を担います。そして、これら多様なオルガネラの機能は互いに精妙に調節され、バランスを取りながら、全体として細胞、組織、ひいては個体レベルでの恒常性を保ちます。本研究室では、このような恒常性を担うメカニズムとして「タンパク質分解」に焦点を当てて研究を進めています。特に(1)細胞自身の成分をリソソームで分解する「オートファジー」、(2)「ユビキチン‐プロテアソーム分解系」、(3)メンブレントラフィックによって細胞膜成分をリソソームに運ぶ「エンドソーム・リソソーム分解系」に注目しています。以下に最近の研究例を紹介します。
(1)オートファジーに関する研究
自身の成分をリソソームで分解する現象をオートファジーとよび、隔離膜が細胞質成分を囲んでリソソームに運ぶ方式を「マクロオートファジー」、リソソーム膜が陥入することで細胞質を直接取り込んで分解する方式を「ミクロオートファジー」とよびます。また、特定の細胞質成分を分解する「選択的オートファジー」とアミノ酸飢餓時に誘導される「非選択的オートファジー」が知られています。ミトコンドリアやペルオキシソームなど、オルガネラの品質管理を担うほか、さまざまな病気で生じる凝集体の処理に働くことが分かっています。
① 電子顕微鏡解析によるオートファジー過程の可視化
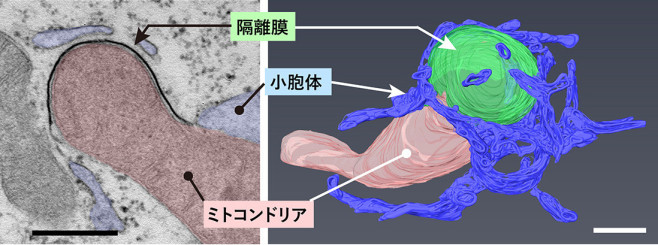
オートファジーが発動すると、まず隔離膜(ファゴフォア)という扁平な二重膜が出現し、これが伸張して細胞質の一部を取り囲み、伸長端が閉じると球状のオートファゴソームになります。そして、ここにリソソームが融合することで加水分解酵素が供給され、内容物が分解されます。この過程はライブセルイメージングや電子顕微鏡解析で確立されましたが、隔離膜がどのように発生し、伸びていくかについては良く分かっていません。この課題に対し、私たちは哺乳類培養細胞を使って3次元電子顕微鏡解析を行ってきました。その結果、小胞体とコンタクトする隔離膜の様子を捉えることに成功しました(Uemura et al., MCB, 2014; Yamashita et al., JCB, 2025)。このことは小胞体から隔離膜へ脂質が供給されることを示唆します。さらにマイトファジーではマイトファジーレセプターによって隔離膜がミトコンドリアに密着しながら伸びること(図1; Yamashita et al., JCB, 2025)や、自然免疫分子STINGがミクロオートファジーによって分解され、シグナルの収束を担うこと(Kuchitsu et al., Nat Cell Biol, 2023)を明らかにしました。
光学顕微鏡の解像度で生体膜の形態や動態を捉えるのは未だ困難です。今後も電子顕微鏡を駆使して、細胞内分解現象の全体にわたりそれら形態基盤を追求していきます
② 浸透圧ストレスに応答した細胞内リモデリングの解明
浸透圧ストレスは広く知られたストレスの1つであり、細胞内外の物質濃度差によって引き起こされます。特に、哺乳類細胞が高張液に曝された場合、水が細胞外へと強制的に漏出して細胞内物質濃度が急激に高まります。このとき、細胞内では不溶性タンパク質の蓄積が生じますが、細胞はこれを負荷(ストレス)として認識し、多様な応答経路を駆動して除去することで恒常性を維持します。脂質膜で囲まれないオルガネラは非膜性オルガネラmembraneless organelle(MLO)として知られています(生体分子凝集体 biomolecular condensatesや液滴liquid dropletともよばれる)。近年、哺乳類の培養細胞を用いた実験で、高浸透圧ストレス下で多様なMLOが形成され、細胞の恒常性維持に深く関わることが明らかになりました。MLOは筋萎縮性側索硬化症などの神経変性疾患に関与することが分かっており、その分子基盤の解明に科学界の関心が高まっています。
私達は、哺乳類の培養細胞を用いて、オートファジーレセプターSQSTM1/p62が高浸透圧ストレス下でMLO(p62 body)を形成し、不要になったユビキチン化分子の分解に関与することを世界で初めて見出しました(Tamura et al., 2019, MCB)。現在、高浸透圧ストレス下に形成されるp62 bodyの分子基盤と他のMLOとの性状の違いに注目して研究を進めています。
③ クラミジア感染におけるATG9Aの役割
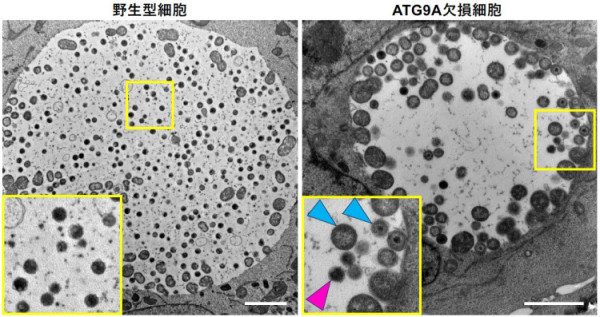
ATG9Aは脂質スクランブラーゼとしての機能をもち、マクロオートファジーには必須です。しかし、それ以外の機能も提唱されています。私達は、ATG9がそのオートファジー機能とは異なる働きにより宿主細胞内でのクラミジアの増殖を促進していることを明らかにしました(Suzuki et al., 2023, Microbiology Spectrum)。
(2)ユビキチン‐プロテアソーム分解系に関する研究
不要になったタンパク質にはユビキチン鎖が付加され、高分子複合体のプロテアソームで分解されますが、この選択的分解システムは細胞分裂や各種ストレス反応の制御機構を担います。特に私達は脂質動態・代謝に関連したユビキチン‐プロテアソーム分解に注目しています。
- UBXD8 (別名FAF2)の機能解析
UBXD8(別名FAF2)は、p97/VCPと結合するUBXドメインとユビキチンを認識するUBAドメインをもっており、ユビキチン-プロテアソーム系によるタンパク質分解に関与するアダプタータンパク質です。全身のさまざまな組織で発現しており、ノックアウトマウスが胎生致死になることから、生体にとって欠かせない重要な役割を担っていると考えられます。UBXD8は脂質代謝に関わる小胞体や脂肪滴、ミトコンドリア、ペルオキシソームといった複数のオルガネラに局在していますが、それぞれの場所でどのような機能を担うのかは十分に分かっていません。私達は、特定の組織だけでUBXD8を欠損させたマウスの解析や、培養細胞を使った実験を通して、UBXD8の生理的な役割と各オルガネラにおける機能の違いを明らかにすることを目指しています。
(3)エンドソーム・リソソーム分解系に関する研究
受容体などの細胞膜タンパク質はエンドサイトーシスによって細胞内に取り込まれ、その後初期エンドソームと後期エンドソームを経てリソソームに運ばれ、分解されます。しかし、エンドソームからリサイクリングエンドソームを経て細胞膜に戻る経路も存在し、多くの膜タンパク質はこの機構を利用して細胞膜局在を維持します。がん病態に関連する上皮成長因子受容体EGFRもその一つであり、私達はその挙動やリサイクリング制御因子に注目しています。

- EGFRの細胞膜局在を維持するAP-1とGGA2の機能解析
クラスリンアダプターとして知られるAP-1 (adapter protein 1)とGGA2 (Golgi-localized, γ-adaptin ear containing,ADP ribosylation factor-binding protein 2)は、ゴルジ体-エンドソーム間の小胞輸送を制御する細胞質因子として知られています。最近私達は、これらタンパク質がEGFRのリサイクリングを促進してそのリソソーム分解を回避していること、そして実際に複数のがんで発現が高いことを見出しました(図4;Uemura et al., Sci Rep, 2018; Uemura et al., Oncogenesis, 2021, Hoshi et al., Breast Cancer 2024)。これはこの機構ががんの増殖能を支えていることを示唆するものです。
その他、この機構を制御しうる他の細胞質制御因子や酸化ストレスとの関係性について研究を進めています。

